Galvanische Korrosion bei Bohrhaken
Die galvanische Korrosion bei Bohrhaken ist wohl eine der größten Sicherheitsrisiken bei Kletterrouten. Sie wird oft auch als Kontaktkorrosion oder Bimetallkorrosion bezeichnet. Durch sie wird die Bruchlast der betroffenen Bauteile negativ beeinflusst.
Wir wollen daher umfassend über dieses Thema aufklären.
Erstens über das Prinzip dieser Korrosionsart. Zweitens stellen wir praktische Beispiele vor. Und drittens geben wir Euch einfache Tipps zur Vermeidung.

Prinzip Galvanische Korrosion
Vereinfacht dargestellt gibt es die galvanische Korrosion bei Bohrhaken aus folgendem Grund. Es wurden Bauteile mit unterschiedlich edlen Metallen verarbeitet. Z.B. ein verzinkter Bohrhaken mit einer Edelstahl Lasche.
Durch den Einfluss von Wasser beginnen dann Elektronen zu wandern. Und zwar vom unedlen Metall zum edlen Metall. Dabei wird das unedle Metall zersetzt („oxidiert“). Um bei unserem Beispiel zu bleiben. Der verzinkte Bohrhaken (=unedles Metall) beginnt zu „rosten“.
Das edle Metall, die positiv geladene Kathode, wird dabei „reduziert“.
Dies geschieht vor allem genau hinter der Bohrhakenlasche im Bohrloch. Denn zwischen Gewinde und Felsen kann sich perfekt das Wasser ansammeln. Es wirkt dann als sogenanntes „Elektrolyt“. D.h. als Flüssigkeit durch welche die Elektronen fließen können.
Somit kann dieser chemische Prozess – der vereinfacht gesagt wie eine kleine Batterie funktioniert – ungehindert fortschreiten. Über Jahre nimmt somit die Bruchlast des unedlen Bauteils stetig ab und wird irgendwann zu einer Gefahr. Denn es werden die maximalen Bruchlast Werte deutlich unterschritten.
Auch Stände und Rapid Glieder betroffen
Leider betrifft die galvanische Korrosion bei Bohrhaken auch sehr oft die Umlenker / Kettenstände. Hier wurde / wird klassischer Weise ein Edelstahl Umlenker auf verzinkte Bohrhaken montiert.
Bitte beachtet auch. Es kommt ebenfalls zu Bimetallkorrosion, wenn ihr ein verzinktes Schraubglied-Rapid Glied in eine Edelstahl Bohrhakenlasche einhängt oder umgekehrt!

Bei Klebehaken kann es zu keiner Kontaktkorrosion kommen. Denn ein Klebehaken besteht nur aus einer Metallart!
Stärkere Korrosion bei „salziger“ Umgebung
Die Kontaktkorrosion bei Bohrhaken hängt vereinfacht dargestellt ab von folgenden Faktoren:
– Salzgehalt des „Elektrolyt“: Je „aggressiver“ das Wasser, desto stärker die Reaktion der beiden unterschiedlichen Metalle.
– Umgebungstemperatur: Im Bereich von 25°-35° C bietet Salzwasser die beste Löslichkeit für viele Salze und führt in diesem Temperaturbereich zu beschleunigter Korrosion.
Folglich kann der Grad der galvanische Korrosion bei Bohrhaken sehr unterschiedlich sein. An einem schattigen und trockenen Granit Felsen wird sie eher gering sein. An einem feuchten und sonnigen Kalk Felsen eher hoch.
Unten im Artikel findest Du die einzelnen Prozesse genau erklärt!
Hier geht´s zum Beitrag zur galvanischen Korrosion / Kontaktkorrosion auf Wikipedia.

Praktische Ursachen galvanische Korrosion
Für die Verarbeitung von Komponenten aus verschiedenen Metallen gibt es viele praktische Ursachen. Im Folgenden wollen wir aus unserer Sicht die drei wichtigsten Ursachen vorstellen:
- fehlendes Bewusstsein / Know-How: vielen Erschließern ist das Prinzip der Kontaktkorrosion bei Bohrhaken einfach nicht bewusst. Kurzum: sie verarbeiten unterschiedlich edle Komponenten beim Einbohren ohne sich im Klaren zu sein was es nach sich zieht.
- falsche Lagerung: Wie Lagerung? Ja, genau, Lagerung! Oft ist das „schlampige“ Zusammenwerfen der Bohrhaken, Bohrhakenlaschen, Befestigungsmuttern und Beilagscheiben bei der Lagerung die Ursache für die Bimetallkorrosion. Wenn man verzinkte und Edelstahl Komponenten einmal in der „Einbohrkiste“ durcheinander gebracht, ist das falsche Zusammenbauen recht wahrscheinlich.
- abgefallene Laschen: Jeder Kletterer kennt die Situation. Du steigst in eine Route ein und es fehlt plötzlich irgendwo die Bohrhakenlasche! Darauf hin ersetzt irgendwer die Lasche, die Beilagscheibe und die Befestigungsmutter. Sehr oft „schwindeln“ sich dabei Komponenten mit einer unterschiedliche Stahlqualität dazu.
Vermeidung Kontaktkorrosion
So vermeidet man die galvanische Korrosion bei Bohrhaken.
Erstens sollte man wenn möglich, auf verzinkte Bohrhaken oder verzinkte Bohrhakenlaschen gänzlich verzichten.
Klettergartenhalter sollten sich diese Frage bei der Klettergarten Errichtung erst gar nicht stellen. Sie müssen durch die Änderung der EN Norm 959 mittlerweile ohnehin Komponenten aus Edelstahl verwenden. Damit sollte es hier bei Neuerschließungen zu keinen Problemen mehr kommen. Bzw. ist es ein klares Plädoyer für eine rasche Klettergarten Sanierung, um seine rechtlichen Risiken zu minimieren.
Bei Erschließern die Neurouten aus eigener Tasche finanzieren, ist die Verwendung des wesentlich günstigeren verzinkten Stahls nur zu verständlich. Deswegen sollte man zweitens – wenn schon verzinkte Bauteile – alles aus verzinktem Stahl nehmen. D.h. Bohrhaken sowie die Lasche.
Natürlich gilt auch hier. Wenn möglich, verwendet Edelstahl Bauteile weil sie einfach viel länger halten!
Drittens. Seid bei der Lagerung Eurer Einbohr Hardware sehr sorgsam. Bringt Komponenten aus Edelstahl und verzinktem Stahl nicht durcheinander. Am besten ihr habt sowohl eine kleine Kiste für verzinkte als auch für Edelstahl Material. So vermeidet ihr diesen klassischen Fehler beim Einbohren von Kletterrouten mit Bohrhaken!
Viertens muss man eine entsprechende Aufklärungsarbeit leisten um das Einbohr Know-How in der Community zu erhöhen. Um zum Beispiel der fehlenden Lasche zurück zu kommen. Nur so kann verhindert werden, dass ohne Nachdenken irgendwelche Laschen aufgeschraubt werden.
Hierzu findet ihr weitere Fachbeiträge von uns im Einbohr Blog!
„Klettergarten Haltern sind durch die Änderung der EN Norm 959 ohnehin dazu verpflichtet, Edelstahl Produkte zu verwenden.“
Klettergarten Check
Bolting.eu bietet im Rahmen seiner Services den Klettergarten Check an. Dabei schauen wir uns alle gewünschten Kletterrouten bzw. Sektoren auf Herz und Nieren an.
Dabei halten wir – neben anderen Kriterien – auch nach galvanischer Korrosion bei Bohrhaken Ausschau.
Überdies machen wir repräsentative Auszugstest und können eine Aussage über den Zustand der Absicherung machen.
Detaillierte Erklärungen
„Korrosion“ kommt vom lateinischen „corrodere“ und bedeutet „zerfressen“ oder „zersetzen“. In der Chemie bedeutet Korrosion also die Zersetzung eines Stoffes. Dies geschieht durch Reaktion eines meist metallischen Bauteils mit weiteren Komponenten aus seiner Umgebung. Hierfür braucht es einen Stoff der die beiden Reaktions-Elemente miteinander „verbindet“. Ein sogenanntes Korrosionselement. Wasser mit gelösten Salzen („Elektrolyt“) zum Beispiel, ist ein perfektes Beispiel.
Das folgende Bild veranschaulicht das Prinzip. Der Bohrhaken ist aus unedlem Metall, verzinktem Stahl. Die Bohrhakenlasche sowie die Befestigungsmutter sind aus Edelstahl. Die beiden unterschiedlichen Metalle stellen die Reaktionspartner dar. Das Korrosionselement ist das Wasser. Es sammelt sich im Bohrloch hinter der Bohrhakenlasche am Gewindeschaft. Deshalb ist die Korrosion hier am größten.
Diese Art von Korrosion beschreibt die Zersetzung von zwei unterschiedlich edlen Metallen. Sie reagieren durch Mithilfe einer „leitenden“ Flüssigkeit („Elektrolyt“) miteinander.
Die Metalle wirken dabei wie Elektroden. Das sind unterschiedlich geladene Pole die Ihren Spannungsunterschied ausgleichen wollen. Daher tauschen Sie Elektronen über die „leitende“ Flüssigkeit aus. Vereinfacht gesagt entsteht dadurch ein „Stromfluss“ .
Das funktioniert vereinfacht so:
Die Elektronen aus den Atomen des unedleren Metalls wandern zuerst über die „leitende“ Flüssigkeit in das edlere Metall.
Im unedlen Metall bleiben also Atome mit „zu wenig“ Elektronen über. Diese werden daher als negativ geladene Ionen bezeichnet. Folglich wird das unedle Metall zum negativ geladenen Pol (Anode).
Im edlen Metall werden die Elektronen aus der „leitenden“ Flüssigkeit aufgenommen. Dadurch haben diese Metallatome aber plötzlich ein Elektron zu viel. Sie werden also zu „positiv“ geladenen Ionen. Folglich wird das edle Metall zum positiven Pol (Kathode).
Über die leitende Flüssigkeit versuchen die beiden Pole nun Ihren Spannungsunterschied auszugleichen. D.h. es beginnen die Elektronen im Kreis zu fließen. Ein geschlossener Stromkreislauf entsteht.
Allerdings gleichen Sich die Potentiale nie ganz aus. Das unedle Metall gibt mehr Elektronen ab als es zurück bekommt. Durch „Oxidation“ entsteht wieder eine stabile Verbindung. Dadurch wird im Laufe der Zeit das Metall aber zerstört. D.h. es „rostet“.
Das edle Metall nimmt folglich mehr Elektronen auf als es abgibt. Es wird zum „reduziert und dadurch geschützt.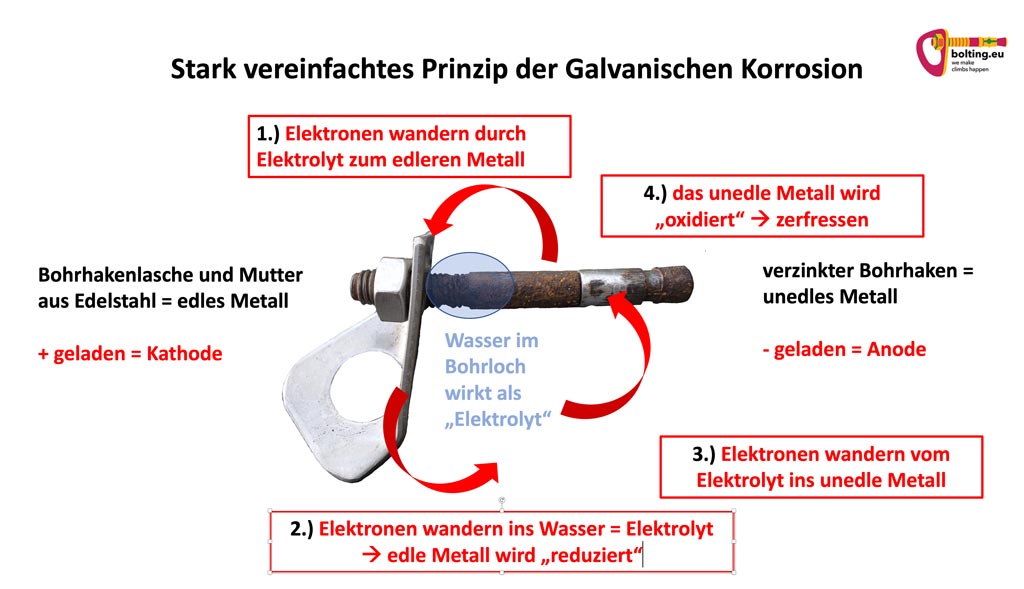
Erstens muss zumindest einer der Komponenten des Fixpunktes aus einem unterschiedlichen Metall bestehen. In der Regel sprechen wir hier von verzinktem Stahl. Das kann also der Bohrhaken selbst, sowie / oder die Bohrhakenlasche, Beilagscheibe und die Befestigungsmutter sein.
Zweitens braucht es auch Wasser sowie entsprechend Zeit.
Die drei klassischen Kombinationen für das fälschliche Mischen von ungleichen Metallen sind.
1.) Bohrhaken (+ Beilagscheibe + Mutter) aus verzinktem Stahl und die Bohrhakenlasche aus Edelstahl
2.) Bohrhakenlasche aus verzinktem Stahl und der Bohrhaken (+ Beilagscheibe + Mutter) aus Edelstahl
3.) Misch-Masch von Komponenten aus verzinktem Stahl und Edelstahl
Das notwendige Wasser für die galvanische Korrosion bei Bohrhaken kommt dann ganz einfach vom Regen oder der Luftfeuchtigkeit.
Es bleibt im Bohrloch perfekt zwischen den einzelnen Komponenten hängen. Dort wirkt es als „leitende“ Flüssigkeit („Elektrolyt“) zwischen den beiden unterschiedlichen Metallen. Sie stellen unterschiedlich geladene Pole dar, die Ihr Spannungspotential ausgleichen wollen.
Hierzu wandern die Elektronen vom verzinkten Stahl über das Wasser zum Edelstahl. Dann weiter ins Elektrolyt. Letztlich gelangen Sie wieder zurück zum verzinkten Stahl. Die Elektronen beginnen zu „fließen. D.h. es entsteht ein geschlossener Stromkreislauf.
Das unedle Metall (- Pol) wird wird dabei zum sogenannten „Reduktionsmittel“. Der verzinkte Stahl wird letztlich oxidiert und „aufgefressen“.
Der Edelstahl (+ Pol) hingegen wird zum „Oxidationsmittel“. Der Stahl wird durch die Reaktion geschützt.
